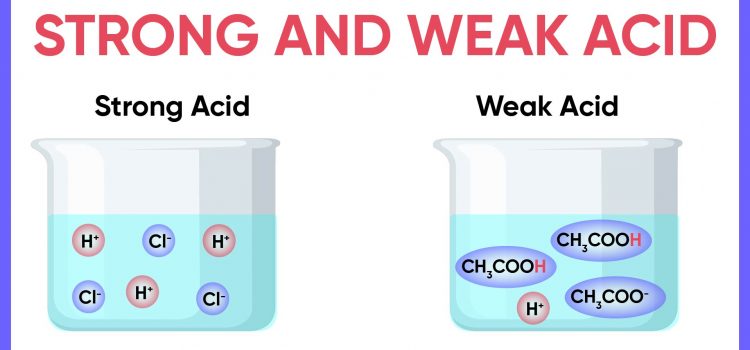
در علم شیمی، هر اسیدی که به عنوان اسیدقوی برچسب خورده باشد، لزوماً خیلی قوی یا خورنده نیست. در عوض، عاملی که در طبقه بندی اسیدهای قوی تصمیم می گیرد، توانایی آنها در آزاد سازی یون های هیدروژن (H+) در یک محلول معین است.
به عبارت ساده، هنگامی که یک اسید قوی را با آب (H2O) مخلوط می کنید، به طور کامل به شکل یونی H+ و یک آنیون تجزیه می شود. به بیان ساده تر، تمام مولکول های یک اسیدقوی در یک محلول تجزیه می شوند. هر اسیدی که نتواند این کار را انجام دهد، در لیست اسیدهای ضعیف قرار می گیرد. این اسیدهای ضعیف به شکل محلول کمتر از 1% تجزیه می شوند.
به این معنی که وقتی اسیدهای ضعیف در آب حل می شوند، تمام مولکول های آنها به طور کامل تجزیه نمی شود. تنها 1% از مولکول های آنها شکسته می شوند و یون هیدروژن آزاد می کنند.
فهرست انواع اسید قوی
تنها هفت اسید قوی رایج در جهان وجود دارد. تمام اسیدهای دیگر که جزء لیست اسیدهای قوی نیستند، اسیدضعیف در نظر گرفته می شوند. این هفت اسیدقوی عبارتند از:
- اسیدکلریک: HClO3
- هیدروبرومیک اسید: HBr
- اسیدکلریدریک: HCl
- اسیدهیدرویدیک: HI
- اسیدنیتریک: HNO3
- اسیدپرکلریک: HClO4
- اسیدسولفوریک: H2SO4
تمام هفت ترکیب موجود در لیست اسیدهای قوی به طور کامل به یون های خود در محلول تجزیه می شوند. بنابراین آنها می توانند یک یا چند پروتون (کاتیون H+) در هر مولکول تولید کنند. حال، اجازه دهید در مورد همه این آنها کمی بیشتر صحبت کنیم.
خواص انواع اسید قوی
اسیدکلریک (HClO3)
این ترکیب به عنوان یک عامل اکسید کننده بسیار قوی محبوب است و ماهیت بسیار اسیدی دارد. وقتی صحبت از جرم مولی HClO3 می شود، 84.45 گرم بر مول محاسبه می شود. این ترکیب از نظر ترمودینامیکی ناپایدار است. با این حال، راهی برای پایدارتر کردن این اسید وجود دارد. برای این کار می توانید این اسید را در محیط های نسبتا سرد قرار دهید.
هیدروبرومیک اسید (HBr)
اسیدی که با حل شدن هیدروژن برومید در آب تشکیل می شود، هیدروبرومیک اسید نامیده می شود. این ترکیب دارای ثابت تفکیک pKa-9 است و با فرمول شیمیایی HBr نشان داده می شود.
این ماده همچنین به عنوان یکی از قوی ترین اسیدهای معدنی شناخته می شود و عمدتاً برای ساخت انواع برمیدهای معدنی استفاده می شود. برخی از آنها عبارتند از برومیدهای سدیم، برومیدهای روی و برومیدهای کلسیم.
در حالی که HBr یک معرف عالی پردازش ترکیبات ارگانوبرومین است، اما می تواند کارهای بیشتری انجام دهد. این اسید قوی می تواند چندین اتر را جدا کند. این ترکیب همچنین در استخراج سنگ معدن نقش بسیار مهمی دارد. این عمل از طریق واکنش های آلکیلاسیون صورت می گیرد.
اسیدکلریدریک (HCl)
این ترکیب یک اسید بی رنگ است که به عنوان اسید موریاتیک نیز شناخته می شود و با فرمول شیمیایی HCl ساخته می شود. این ترکیب ماهیتی بسیار اسیدی و بوی بسیار تندی دارد. هنگام استفاده از آن باید با احتیاط رفتار شود، زیرا توانایی آسیب رساندن به پوست را دارد. این اسید خورنده همچنین دارای ساده ترین سیستم اسیدی (حاوی کلر و آب) است.
اسید هیدرویدیک (HI)
این ترکیب دومین اسیدقوی هیدروژن و هالوژن بعد از اسید هیدرواستاتیک است. این محلول بسیار اسیدی یدید هیدروژن و آب یک معرف شیمیایی پرکاربرد است. همچنین وقتی در محلول آبی قرار می گیرد، کاملاً یونیزه می شود.
اسید نیتریک (HNO3)
این ترکیب اغلب آکوا فورتیس یا روح نیتر نامیده می شود. این اسیدمعدنی بسیار خورنده دارای جرم مولی 63.01 گرم بر مول است. به طور گسترده ای در واکنش های نیتراسیون استفاده می شود، زیرا یک عامل اکسید کننده کاملاً قوی است. بنابراین، افزودن یک گروه نیترو به یک واکنش دهنده معین را بسیار آسان تر می کند.
اسیدپرکلریک (HClO4)
ترکیب بعدی در لیست اسیدهای قوی یک اسید معدنی بی رنگ بسیار قدرتمند است و در محلول آبی استفاده می شود. در مقایسه با اسیدسولفوریک و اسیدنیتریک، اسید قوی تری است. در حالی که به شکل مایع تا حد زیادی استفاده می شود، اما در فرم خشک آن به عنوان یک اکسید کننده قوی عمل می کند.
اسیدسولفوریک (H2SO4)
آخرین و هفتمین ترکیب در لیست اسیدهای قوی، اسیدسولفوریک است. این اسیدمعدنی بی رنگ، بی بو و شامل اکسیژن (O)، گوگرد (S) و هیدروژن (H) است. علاوه بر این، از نظر طبیعت بسیار چسبناک است و محلول در آب است. این ترکیب را می توان در یک واکنش بسیار گرمازا سنتز کرد.
